Instrukcije iz kemije - Kristali
AMORFNE TVARI
Amorfne tvari nemaju pravilnu unutarnju građu i ne smatra ih se pravim čvrstim tvarima, već jako pothlađenim tekućinama. Nemaju određeno talište, pri zagrijavanju postupno mekšaju dok se ne rastale (staklo, vosak).
 |
| Struktura stakla |
KRISTALI
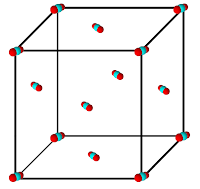
Kristal je pravilno geometrijsko tijelo pravilne unutarnje građe, omeđeno ravnim, međusobno okomito i koso položenim plohama.


Kristali

Ionski kristali
• tvrdi i kruti
• visoko talište i vrelište
• dobro topljivi u vodi i drugim polarnim otapalima
• pri sobnoj temperaturi u čvrstom stanju
• pokretljivi ioni u talini i otopini provode električnu struju
Molekulski kristali
• mekani
• nisko talište i vrelište
• uglavnom netopljivi u vodi, dobro topljivi u organskim otapalima
• najčešće plinovi i tekućine, a ako su čvste tvari lako su hlapljive
• izloatori jer nema električki nabijenih čestica
Atomski kristali
Dijamant
• velika tvrdoća
• visoko talište u vrelište
• praktično netopljiv u svim otapalima
• pri sobnoj temperaturi u čvrstom stanju
• izolator jer nema slobodnih elektrona
Grafit
• mekan
• visko talište i vrelište
• praktično netopljiv u svim otapalima, topljiv u tekućim metalima
• pri sobnoj temperaturi u čvrstom stanju
• dobar vodič električne struje jer između slojeva postoje delokalizirani elektroni
Kristali metala
• tvrdi i kovki
• visoko vrelište i talište
• topljivi samo u tekućim metalima
• pri sobnoj temperaturi u čvrstom stanju osim žive
• dobri vodiči električne struje u čvrstom i tekućem stanju jer su elektroni u kristalu metala pokretljivi
Više informacija i drugih korisnih sadržaja možete naći na poveznicama:
Više informacija i drugih korisnih sadržaja možete naći na poveznicama:
https://poduke.wixsite.com/instrukcije
https://instrukcije-poduke.business.site
Kvalitetne instrukcije iz više predmeta možete dobiti na
telefon (WhatsApp,Viber) 095 812 7777,
Skype: moje.instrukcije
https://instrukcije-poduke.business.site
Kvalitetne instrukcije iz više predmeta možete dobiti na
telefon (WhatsApp,Viber) 095 812 7777,
Skype: moje.instrukcije