INSTRUKCIJE IZ KEMIJE - PERIODIČNOST SVOJSTAVA ELEMENATA
Periodičnosti orbitala čine dva svojstva:
1. Porastom atomskog broja unutar periode atomske orbitale postaju manje i stabilnije.
2. Porastom atomskog broja unutar skupine atomske orbitale postaju veće i nestabilnije.
Osim kemijskih svojstava periodički se mijenjaju i fizička svojstva (polumjer atoma, energija ionizacije).
Polumjer atoma
Atomi i molekule nemaju oštrih granica. Kao volumen slobodnog atoma obično se definira onaj volumen koji sadrži 90 % elektronskog oblaka. Radijus atoma predstavlja polovicu međuatomske udaljenosti dvaju istovrsnih atoma, koji su u dodiru, ali nisu međusobno povezani ni kovalentnom ni ionskom vezom, već vrlo slabom van der Waalsovom vezom.
Polumjeri atoma se u periodi smanjuju od lijeva na desno porastom atomskog broja. Polumjer atoma kroz skupinu raste s porastom atomskog broja, odozgo prema dolje.
Energija ionizacije
Između protona u jezgri i elektrona u elektronskom omotaču djeluje privlačna sila. Dovođenjem određene energije atom prelazi u pobuđeno stanje. Ukoliko je iznos dovedene energije veći elektron se odvaja od atoma i nastaje pozitivno nabijena čestica. Koliki naboj će imati ta čestica ovisi o tome koliko je elektrona otpustila.
Energija ionizacije je energija potrebna da se elektron ukloni iz atoma. Energija ionizacije najmanja je za prvi elektron i za svaki idući raste jer se elektron sada uklanja s pozitivno nabijenog, a ne neutralnog atoma.
Prva energija ionizacije – energija potrebna za udaljavanje prvog elektrona iz električki nenabijene čestice.
Druga energija ionizacije – energija potrebna za udaljavanje drugog elektrona, veća je od prve energije ionizacije.
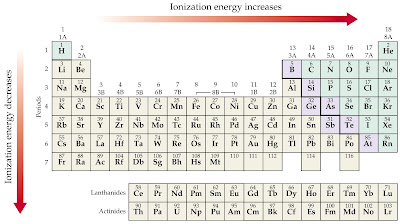
Energija ionizacije opada u istoj skupini periodnog sustava s porastom atomskog broja elementa, a u istoj periodi raste s porastom atomskog broja.
Porastom atomskog broja kroz periodu raste broj protona u jezgri od lijeva na desno. Tako porastom naboja jezgre raste i privlačna sila između protona i elektrona. Energija ionizacije raste unutar periode od 1. do 18. skupine.
Afinitet prema elektronu
Atomi nemetala imaju skoro popunjenu valentnu ljusku i mogu primanjem elektrona postići energetsku povoljniju elektronsku konfiguraciju plemenitog plina (afinitet atoma prema elektronu).
Elektronski afinitet raste unutar periode od 1. prema 18. skupini.
Porastom atomskog broja kroz skupinu afinitet prema elektronu se smanjuje.
Više informacija i drugih korisnih sadržaja možete naći na poveznicama:
https://poduke.wixsite.com/instrukcije
https://instrukcije-poduke.business.site
Kvalitetne instrukcije iz više predmeta možete dobiti na
telefon (WhatsApp,Viber) 095 812 7777,
Skype: moje.instrukcije
https://instrukcije-poduke.business.site
Kvalitetne instrukcije iz više predmeta možete dobiti na
telefon (WhatsApp,Viber) 095 812 7777,
Skype: moje.instrukcije