Instrukcije iz kemije - Kovalentna veza VI
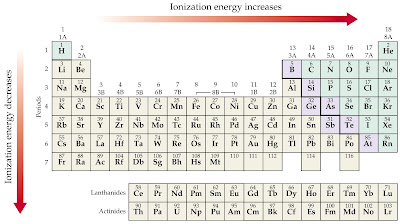
Elektronegativnost atoma
U kovalentnoj vezi između istovrsnih atoma oba atoma jednako sudjeluju u zajedničkom elektronskom oblaku, a težišta pozitivnog i negativnog naboja nalaze se na istom mjestu.

Elektronegativnost je relativna mjera sposobnosti jezgre jednog atoma da privlači elektrone iz zajedničkog elektronskog para.

Linus Pauling (1901. – 1994.)
Elektronegativnost svake pojedine vrste atoma brojčano izrazio koeficijentom elektronegativnosti.
Elektronegativnost svake pojedine vrste atoma brojčano izrazio koeficijentom elektronegativnosti.


Elektronegativnost i kovalentna veze
Razlika u elektronegativnosti atoma u kovalentnoj vezi između raznovrsnih atoma uzrokuje razdvajanje težišta pozitivnog i negativnog naboja.
Nastaju polarne ili dipolne molekule (dipoli).
Nastaju polarne ili dipolne molekule (dipoli).
Veza između atoma različite elektronegativnosti je kovalentna veza s djelomično ionskom prirodom.

δ+ je dio molekule u kojem se nalazi atom manje elektronegativnosti, oko njega je manja gustoća elektronskog oblaka.
δ– je dio molekule s atomom veće elektronegativnosti, oko njega je veća gustoća elektronskog oblaka.
Električni dipolni moment (μ) je mjera za polarnost. To je umnožak električnog naboja i udaljenosti polova.
μ = e ∙ l
μ – električni dipolni moment
e – električni naboj
l – udaljenost težišta pozitivnog i negativnog
Dipolni moment se označava strelicom od pozitivnijeg dijela molekule prema negativnijem.

Svaka molekula s polarnim kovalentnim vezama nije dipolna molekula. U simetrično izgrađenim molekulama dipolni moment je jednak nuli, pa je molekula nepolarna.

Više informacija i drugih korisnih sadržaja možete naći na poveznicama:
https://instrukcije-poduke.business.site
Kvalitetne instrukcije iz više predmeta možete dobiti na
telefon (WhatsApp,Viber) 095 812 7777,
Skype: moje.instrukcije
Kvalitetne instrukcije iz više predmeta možete dobiti na
telefon (WhatsApp,Viber) 095 812 7777,
Skype: moje.instrukcije