Instrukcije iz kemije - Ionska veza
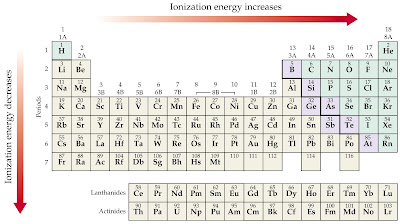
Energija koja je potrebna da bi se izbacio elektron iz atoma u plinovitom stanju zove se energija ionizacije.

Kationi imaju polumjer manji od polumjera odgovarajućeg atoma.

Nemetali imaju veliki afinitet prema elektronu, pa lagano primaju otpuštene elektrone metala (elektrone će primati lakše zato što imaju veću elektronegativnost).

Tvore negativne ione – anione.
Polumjer aniona uvijek je veći od polumjera njegovog atoma (jezgra slabije privlači veći broj elektrona).

Energija koja je potrebna da bi se izbacio elektron iz atoma u plinovitom stanju zove se energija ionizacije.
Ako se iz atoma izbaci jedan elektron potrebno je utrošiti prvu energiju ionizacije.
Za izbacivanje drugog elektrona potrebna je druga energija ionizacije, koja je znatno veća od prve energije ionizacije.
Energija ionizacije opada porastom atomskog broja unutar skupine.
Nastajanje ionske veze
Nastajanje ionske veze između natrija i klora
Atom natrija u valentnoj ljusci ima jedan elektron, a atom klora sedam elektrona.
Lewisovim oznakama prikaz nastajanja ionske veze:
Atom može otpustiti elektrone samo ako postoji drugi atom koji će te elektrone primiti.

Prikaz nastajanja ionske veze kemijskim jednadžbama:


Kristalna rešetka NaCl
Svi procesi tijekom kojih dolazi do prijenosa elektrona pripadaju redukcijsko – oksidacijskim procesima (redoks procesima).
Oksidacija je proces otpuštanja elektrona.
Redukcija je proces primanja elektrona.
Između iona djeluju jake elektrostatske privlačne sile i vrijedi Coulombov zakon:
Privlačna sila (F) između dva suprotno nabijena električna naboja razmjerna je količini naboja Q1 i Q2, a obrnuto razmjerna kvadratu udaljenosti naboja (r).


Ionska veza zbog električne prirode nije usmjerena u prostoru.
Više informacija i drugih korisnih sadržaja možete naći na poveznicama:
https://poduke.wixsite.com/instrukcije
https://instrukcije-poduke.business.site
Kvalitetne instrukcije iz više predmeta možete dobiti na
telefon (WhatsApp,Viber) 095 812 7777,
Skype: moje.instrukcije
https://instrukcije-poduke.business.site
Kvalitetne instrukcije iz više predmeta možete dobiti na
telefon (WhatsApp,Viber) 095 812 7777,
Skype: moje.instrukcije

























